氨基酸是构成蛋白质的基本单位,也是生物体生命活动所必需的重要有机化合物。它们不仅在蛋白质合成中起关键作用,还参与了许多生理过程,如代谢调节、神经传导和免疫反应。近年来,随着生物医学技术的发展,氨基酸的研究领域得到了极大的扩展,尤其是在疾病治疗、营养补充和合成生物学中的应用,备受关注。
麦克林提供各类氨基酸试剂及其衍生产品,具有纯度等级高、生产工艺先进、支持研发定制等特点,能被广泛适用于各类科研项目、研究实验中,欢迎选购。
本文通过以下几点简单介绍麦克林氨基酸试剂的产品特性及相关应用:
1. 氨基酸的基本性质和分类
2. 非天然氨基酸的应用与研究
3. 保护氨基酸在化学合成中的重要性
4. 氨基酸的应用
5. 麦克林氨基酸试剂及衍生产品介绍
氨基酸的基本性质和分类
氨基酸分子由一个氨基(-NH₂)、一个羧基(-COOH)、一个氢原子以及一个特定的侧链(R基团)组成。根据R基团的不同,氨基酸具有不同的物理化学性质,这些性质直接影响它们在蛋白质中的功能和结构稳定性。氨基酸可以根据其来源和合成途径进行分类,包括天然氨基酸和非天然氨基酸。天然氨基酸是自然界中常见的20种标准氨基酸,而非天然氨基酸则是通过化学合成、酶促反应或基因工程技术引入到蛋白质中的不常见氨基酸。这些非天然氨基酸的引入扩展了氨基酸的功能范围,使得科学家们能够设计出具有特殊性质的蛋白质或分子。
非天然氨基酸的应用和研究
非天然氨基酸在生物学研究和生物工程中的应用日益广泛。通过将非天然氨基酸引入到蛋白质中,研究人员能够赋予蛋白质新的功能,或是研究特定功能基团对蛋白质活性的影响。例如,在生物正交化学反应中,利用非天然氨基酸可以引入特定的标记或探针,实现对蛋白质的实时追踪和定位。
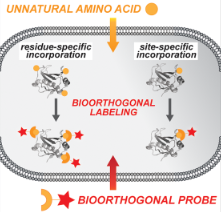
图1 非天然氨基酸的细胞掺入与蛋白质的生物正交标记[1]
此外,非天然氨基酸在药物开发中也展现出独特的优势。通过改变氨基酸侧链的结构,可以设计出更具稳定性和特异性的药物分子。这种技术已经被用于开发新型的蛋白质药物,如抗体和酶类药物,进一步推动了精准医学的发展。
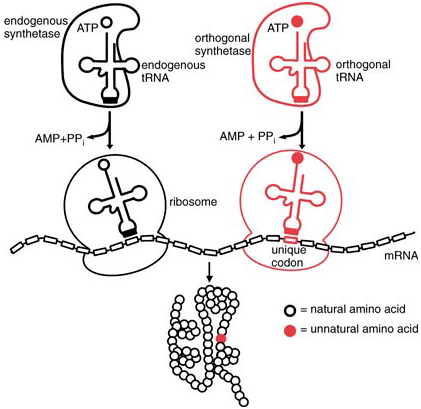
图2 一种在体内将非天然氨基酸特异性引入蛋白质的通用方法。PPi = 焦磷酸盐[2]
保护氨基酸在化学合成中的重要性
在氨基酸的化学合成和多肽合成过程中,保护基团的使用至关重要。保护氨基酸是指在氨基酸的合成过程中,关键的活性基团被暂时保护起来,以避免不必要的副反应。例如,在固相多肽合成中,使用保护基团可以确保氨基酸的氨基和羧基在特定步骤中保持不活跃,只有在需要时才被释放进行反应。这种策略极大地提高了合成复杂多肽和蛋白质的效率与精度。在现代合成化学中,保护氨基酸的技术被广泛应用于开发新型药物和功能性生物材料,为化学合成的可靠性和可控性提供了保障。
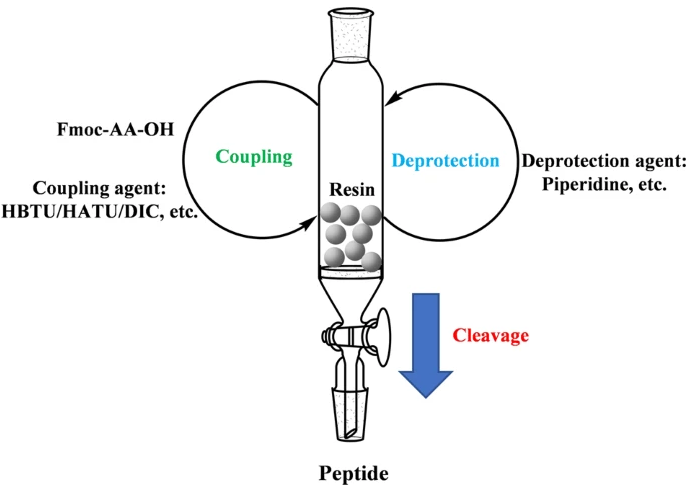
图3 固相肽合成(SPPS)的过程[3]
氨基酸的应用
随着科学技术的进步,氨基酸在多个领域的应用得到了广泛发展。在营养学领域,氨基酸补充剂已被广泛用于运动员、老年人和特殊人群的膳食补充,以改善身体机能和提高免疫力。
在医药领域,氨基酸作为药物开发的基础材料,具有重要的应用前景。例如,L-精氨酸在心血管疾病的治疗中起到重要作用,其通过一氧化氮合成途径改善血管功能。谷氨酰胺则被广泛用于重症患者的营养支持治疗,特别是在应激状态下,有助于免疫功能的维持。
氨基酸还在合成生物学和生物工程领域中得到应用。通过基因工程手段,可以合成具有特定功能的非天然氨基酸,从而设计出新型蛋白质或酶。这为药物开发、材料科学和工业酶的生产提供了新的途径。
麦克林氨基酸试剂及衍生产品介绍
麦克林氨基酸试剂产品优势:
1.结构新颖、品种繁多
2.纯度等级高
3.生产工艺先进
4.接受研发定制
天然氨基酸
L-天冬氨酸
超纯生物试剂级, ≥99.5%(T)
L-谷氨酸
Ultra pure,≥99.5%(NT)
非天然氨基酸
保护氨基酸
参考文献
[1] Lang, K., & Chin, J. W. (2014). Cellular incorporation of unnatural amino acids and bioorthogonal labeling of proteins. Chemical Reviews, 114(9), 4764-4806.
[2] Wang, L. and Schultz, P.G. (2005), Expanding the Genetic Code. Angewandte Chemie International Edition, 44: 34-66.
[3] Wang, L., Wang, N., Zhang, W. et al. Therapeutic peptides: current applications and future directions. Sig Transduct Target Ther 7, 48 (2022).
[4] Wu, G. (2009). Amino acids: metabolism, functions, and nutrition. Amino acids, 37(1), 1-17.
Brosnan, J. T. (2003). Interorgan amino acid transport and its regulation. Journal of Nutrition, 133(6), 2068S-2072S.
[5] Li, P., et al. (2007). Amino acids and immune function. British Journal of Nutrition, 98(2), 237-252.
[6] Li, X., et al. (2021). Branched-chain amino acids and insulin resistance: From molecular aspects to clinical solutions. Journal of Molecular Medicine, 99(5), 689-703.
[7] Chin, J. W. (2014). Expanding and reprogramming the genetic code of cells and animals. Annual Review of Biochemistry, 83, 379-408.
[8] Dawson, P. E., & Kent, S. B. (2000). Synthesis of native proteins by chemical ligation. Annual Review of Biochemistry, 69(1), 923-960.
[9] Merrifield, R. B. (1963). Solid phase peptide synthesis. I. The synthesis of a tetrapeptide. Journal of the American Chemical Society, 85(14), 2149-2154.
[10] Lang, K., & Chin, J. W. (2014). Cellular incorporation of unnatural amino acids and bioorthogonal labeling of proteins. Chemical Reviews, 114(9), 4764-4806.
[11] Muir, T. W., Sondhi, D., & Cole, P. A. (1998). Expressed protein ligation: A general method for protein engineering. Proceedings of the National Academy of Sciences, 95(12), 6705-6710.