什么是抗氧化剂?
抗氧化剂可以保护生物系统免受含氧自由基和氧化还原过渡金属离子(如铁、铜和镉)产生的氧化损害[1]。线粒体中的葡萄糖的氧化代谢过程中,超氧阴离子(O2-)作为辅酶Q复合体III还原的副产品产生。超氧化物歧化酶(产品号:S128537)将超氧阴离子转化为过氧化氢(H2O2),而过氧化氢又可以转化为过氧自由基(RO2-)、羟自由基(OH-)或次氯酸(ClO-)离子。超氧阴离子还可以与一氧化氮(NO)反应,形成高活性的过氧亚硝基阴离子(ONOO-)[2]。在正常情况下,这些细胞氧化剂被细胞内的抗氧化剂和抗氧化酶还原或清除,其中最重要的是谷胱甘肽(产品号:L274260)、硫氧还蛋白、超氧化物歧化酶、过氧化氢酶(产品号:C163049)和过氧化物酶(产品号:P105528)。饮食中的抗氧化剂,如抗坏血酸(维生素C)、维生素E、β-胡萝卜素和其他类胡萝卜素,以及硒,已被认为是细胞和血浆总抗氧化能力的重要成分。类胡萝卜素、叶黄素和玉米黄素是眼睛和视网膜的重要抗氧化剂[3]。维生素E是生育酚和生育三烯酚的混合物,其中α-生育酚(产品号:T105540)是主要的抗氧化剂[4],是细胞中主要的脂溶性抗氧化剂,在保护膜脂质过氧化方面起着重要作用。低密度脂蛋白(LDL)携带维生素E进入细胞,随后通过向脂肪过氧自由基提供氢气来防止LDL的过氧化反应[5]。多酚类化合物,特别是黄酮类化合物,最近已被证明是培养细胞中强有力的抗氧化剂。对黄酮类化合物的人体研究也表明,其效果可部分归因于其抗氧化作用[6]。抗氧化剂可以直接作为还原剂,将质子氢提供给未配对的氧电子,或通过稳定或转移自由基电子而发挥作用[7]。在这个过程中,还原剂被氧化;例如,两个谷胱甘肽分子的半胱氨酸巯基被氧化,形成氧化谷胱甘肽的分子间胱氨酸(图1)。
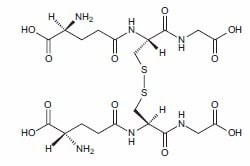
图1.氧化的谷胱甘肽的结构
膳食抗氧化剂的研究
硫辛酸是一种内源性抗氧化剂,最近作为膳食补充剂受到关注,因为它不仅可以清除自由基,而且它的二氢脂酸盐形式也是非常有效的还原剂。硫辛酸能减少其他抗氧化剂的氧化形式,并最终能保持组织中还原谷胱甘肽的浓度[8]。一些抗氧化剂捕获或清除自由基,并在这个过程中成为自由基本身。当类胡萝卜素虾青素(图2)、叶黄素和玉米黄素清除氧自由基时,未配对电子的电荷在分子的整个多烯链上变得分散[9]。黄酮醇槲皮素被氧化为醌,可与硫醇反应[10]。 黄酮类化合物也是很好的金属离子螯合剂,可以防止铜催化的LDL过氧化[1,4,11]。在螯合铜和防止低密度脂蛋白过氧化方面,白藜芦醇(产品号:R107315)比黄酮类化合物更有效力[12]。这可能有助于白藜芦醇和黄酮类化合物的抗动脉硬化作用。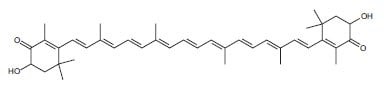
图2.虾青素的结构
最新研究进展
Moskaug等人推测,黄酮类化合物通过诱导细胞中的慢性低水平氧化应激来增强细胞的抗氧化系统,从而提高细胞的抗氧化防御系统(激素原理)[15]。 相反,Halliwell等人认为,未被吸收的微摩尔浓度的黄酮类化合物和其他酚类化合物仍然留在小肠和结肠中,它们的抗氧化、金属螯合和其他作用对结直肠癌的发生有保护作用。最近的研究证实,多酚类物质除了清除自由基和螯合金属离子外,还具有许多细胞内效应。活性氧(ROS)和活性氮(RNS)也是潜在的信号分子。它们通过一类对氧化还原敏感的转录因子调节基因表达的研究,包括诱导抗氧化/解毒酶表达的Nrf2,以及诱导产生炎症细胞因子、细胞粘附分子、急性期蛋白和抗凋亡的NFkB和AP-1[1,2,16]。这些转录因子在应对氧化应激时被激活;持续升高的活性氧(ROS)水平通过诱导其抑制性亚基IkB的磷酸化和分离而激活NFkB。据报道,水飞蓟素(产品号:S408123)和水飞蓟宾(产品号:S1098009)[17]、儿茶素和原花青素(产品号:P413229),[1,11]以及其他黄酮类化合物[16]可以阻止NFkB的激活。Forman等人引用证据表明,过氧化氢和超氧阴离子通过介导氧化还原信号反应表现出第二信使的特性。他们假设过氧化物与存在于信号蛋白活性部位的关键半胱氨酸硫酸盐可逆地相互作用[18]。已知蛋白酪氨酸磷酸酶和硫氧还蛋白具有硫酸盐形式的活性部位半胱氨酸,而转录因子AP-1和NFkB以及一些半胱天冬酶具有可能是硫酸盐形式的氧化还原敏感半胱氨酸。一些蛋白激酶c(产品号:P343699)异构体调节部位的锌结合的半胱氨酸也可能被过氧化氢氧化。受体刺激产生的过氧化物也导致所有有丝分裂原激活蛋白激酶途径(ERK、JNK和p38 MAPK)的激活。其他信号蛋白和酶是一氧化氮、过氧化物或两种氧化剂的目标(表1)。因此,清除活性氧中间物的抗氧化剂多酚可能对介导细胞对氧化应激反应的细胞内信号转导途径有深远的影响。
|
信号蛋白
|
调节剂氧化剂
|
|
PTP1B
|
NO, H₂O₂
|
|
SHP-2
|
H₂O₂
|
|
LMW-PTP
|
NO, H₂O₂
|
|
PTEN
|
H₂O₂
|
|
Trx
|
NO, H₂O₂
|
|
Src
|
H₂O₂
|
|
Ras
|
NO, H₂O₂
|
|
GSTp/JNK
|
H₂O₂
|
|
Gi/Go
|
H₂O₂
|
|
NMDA
|
NO
|
表1.氧化还原信号的其他靶点
参考文献
1. Frei B, Higdon JV. 2003. Antioxidant Activity of Tea Polyphenols In Vivo: Evidence from Animal Studies. The Journal of Nutrition.133(10):3275S-3284S. https://doi.org/10.1093/jn/133.10.3275s
2.Chew BP, Park JS. 2004. Carotenoid Action on the Immune Response. The Journal of Nutrition.134(1):257S-261S. https://doi.org/10.1093/jn/134.1.257s
3.Ribaya-Mercado JD, Blumberg JB. 2004. Lutein and Zeaxanthin and Their Potential Roles in Disease Prevention. Journal of the American College of Nutrition. 23(sup6):567S-587S. https://doi.org/10.1080/07315724.2004.10719427
4.Halliwell B, Rafter J, Jenner A. 2005. Health promotion by flavonoids, tocopherols, tocotrienols, and other phenols: direct or indirect effects? Antioxidant or not?. The American Journal of Clinical Nutrition.81(1):268S-276S. https://doi.org/10.1093/ajcn/81.1.268s
5.Chattopadhyay A, Bandyopadhyay D. 2006. . Vitamin E in the prevention of ischemic heart. . Pharmacological reports . 58(179):179-187. . https://pubmed.ncbi.nlm.nih.gov/16702619/
6.Williamson G, Manach C. 2005. Bioavailability and bioefficacy of polyphenols in humans. II. Review of 93 intervention studies. The American Journal of Clinical Nutrition.81(1):243S-255S. https://doi.org/10.1093/ajcn/81.1.243s
7.Grajek W, Olejnik A, Sip A. Probiotics, prebiotics and antioxidants as functional foods.. Acta Biochim Pol. 52(3):665-671. https://doi.org/10.18388/abp.2005_3428
8.Bilska A, Wlodek L. 2005. . Lipoic acid-the drug of the future. . Pharmacol Rep . 57(5):570-577.. https://pubmed.ncbi.nlm.nih.gov/16227639/
9.Liu RH. 2004. Potential Synergy of Phytochemicals in Cancer Prevention: Mechanism of Action. The Journal of Nutrition.134(12):3479S-3485S. https://doi.org/10.1093/jn/134.12.3479s
10.Moskaug JØ, Carlsen H, Myhrstad MC, Blomhoff R. 2005. Polyphenols and glutathione synthesis regulation. The American Journal of Clinical Nutrition.81(1):277S-283S. https://doi.org/10.1093/ajcn/81.1.277s
11.Keen Cea. 2005. Cocoa antioxidants and cardiovascular health. Am. J. Clin. Nutr.The American Journal of Clinical Nutrition. 81, 298S-303S .https://doi.org/10.1093/ajcn/81.1.298S
12.Pervaiz S. 2003. Resveratrol: from grapevines to mammalian biology.The FASEB journal. 17(14):1975-1985. https://doi.org/10.1096/fj.03-0168rev
13.Crespy V, Williamson G. 2004. A Review of the Health Effects of Green Tea Catechins in In Vivo Animal Models. The Journal of Nutrition.134(12):3431S-3440S. https://doi.org/10.1093/jn/134.12.3431s
14.Schroeter H, Heiss C, Balzer J, Kleinbongard P, Keen CL, Hollenberg NK, Sies H, Kwik-Uribe C, Schmitz HH, Kelm M. 2006. (-)-Epicatechin mediates beneficial effects of flavanol-rich cocoa on vascular function in humans. Proceedings of the National Academy of Sciences. 103(4):1024-1029. https://doi.org/10.1073/pnas.0510168103
15.Scalbert A, Johnson IT, Saltmarsh M. 2005. Polyphenols: antioxidants and beyond. The American Journal of Clinical Nutrition.81(1):215S-217S. https://doi.org/10.1093/ajcn/81.1.215s
16.Surh Y, Kundu JK, Na H, Lee J. 2005. Redox-Sensitive Transcription Factors as Prime Targets for Chemoprevention with Anti-Inflammatory and Antioxidative Phytochemicals.The Journal of Nutrition. 135(12):2993S-3001S. https://doi.org/10.1093/jn/135.12.2993s
17.Kren V, Walterova D. 2005. Silybin and silymarin - new effects and applications. BIOMED PAP. 149(1):29-41. https://doi.org/10.5507/bp.2005.002
18.Forman HJ, Fukuto JM, Torres M. 2004. Redox signaling: thiol chemistry defines which reactive oxygen and nitrogen species can act as second messengers. American Journal of Physiology-Cell Physiology. 287(2):C246-C256. https://doi.org/10.1152/ajpcell.00516.2003